

1 资料与方法
1.1 一般资料
2014年3月至2016年12月广西医科大学第一附属医院体检中心1 157名健康体检人群, 年龄14~86岁, 男767名, 占66.3%, 女390名, 占33.7%。体检人员均进行自身抗体相关项目、常规血液、免疫学指标等检测。所有人群均采集清晨空腹静脉血, 并分离血清备用。所有项目均在抽血当天完成检测。
1.2 方法
采用间接免疫荧光法 (indirect immunofluorescence assay, IIF) 检测血清抗核抗体 (antinuclear antibody, ANA) 、抗双链DNA (double stranded DNA, dsDNA) 抗体, 线性免疫印迹技术 (line immunoassay, LIA) 检测抗核抗体谱 (ANAs) 。ANA, 抗dsDNA抗体和ANAs均采用试剂盒 (德国欧蒙医学实验诊断股份公司) , LIA采用全自动免疫印迹仪 (德国欧蒙医学实验诊断股份公司) 及EUROLineS-can自动判别软件 (德国欧蒙医学实验诊断股份公司) 。ANA抗体滴度为1∶100时判读为弱阳性, 1∶100为阳性, 并记录荧光核型。抗dsDNA抗体滴度为1∶10判读为弱阳性, 1∶10为阳性。ANAs结果5为阴性, 6~10为弱阳性, 11为阳性。HITACHI 7600全自动生化分析仪检测免疫学功能指标C反应蛋白 (CRP) 、IgG、IgA、IgM。MONI-TOR100血沉分析仪检测血沉 (ESR) 。
1.3 统计学方法
采用SPSS 19.0统计软件, 计数资料用例数或百分率表示, 计量资料以表示, 两组间率的比较采用X2检验, 免疫学指标多为偏态分布, 故采用非参数检验中2个独立样本的U检验进行分析。以P0.05为差异有统计学意义。
2 结果
2.1 1 157名体检者自身抗体的阳性率
1 157名体检者ANA阳性率为7.35%, 其中女性阳性率高于男性阳性率 (12.56%vs 4.69%, X2=23.528, P=0.000) , ANAs的总体阳性率为3.80%, 其中女性阳性率高于男性阳性率 (5.90%vs 2.73%, X2=7.055, P=0.008) 。抗dsDNA抗体及ANAs各项特异性抗体在男性和女性健康体检者中的阳性率差异无统计学意义 (P0.05) 。见表1。
表1 1 157名健康体检者自身抗体结果
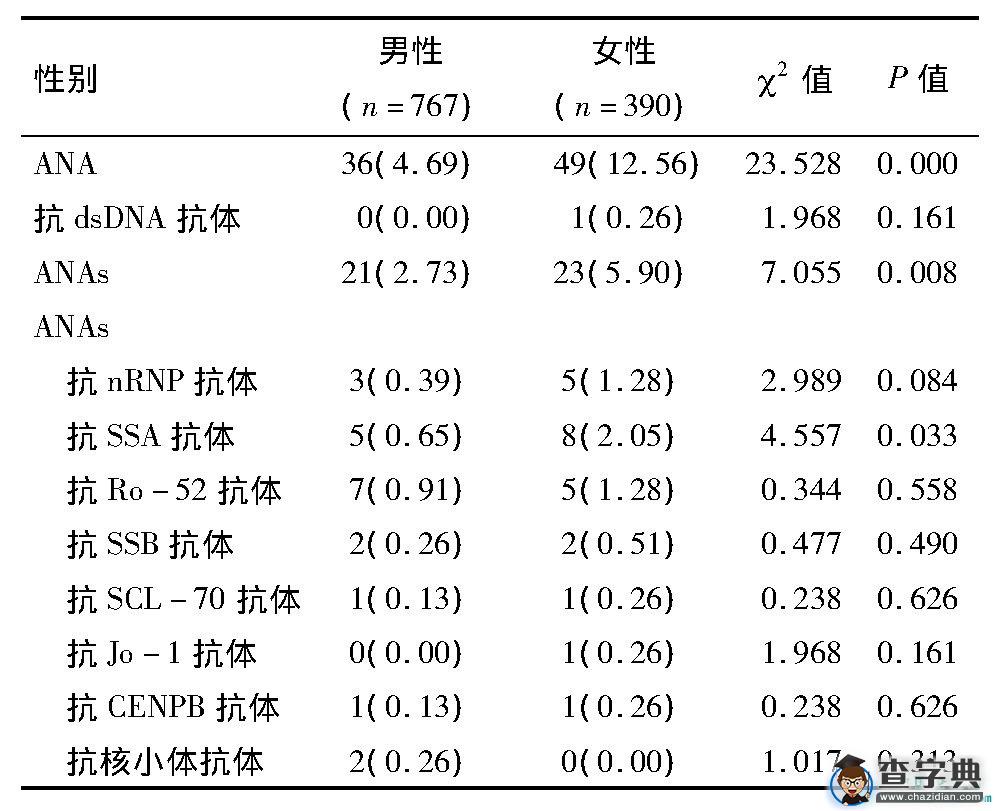
注:抗Sm抗体、抗组蛋白抗体、抗核糖体抗体无阳性, 未做统计
2.2 100例自身抗体异常者随诊情况
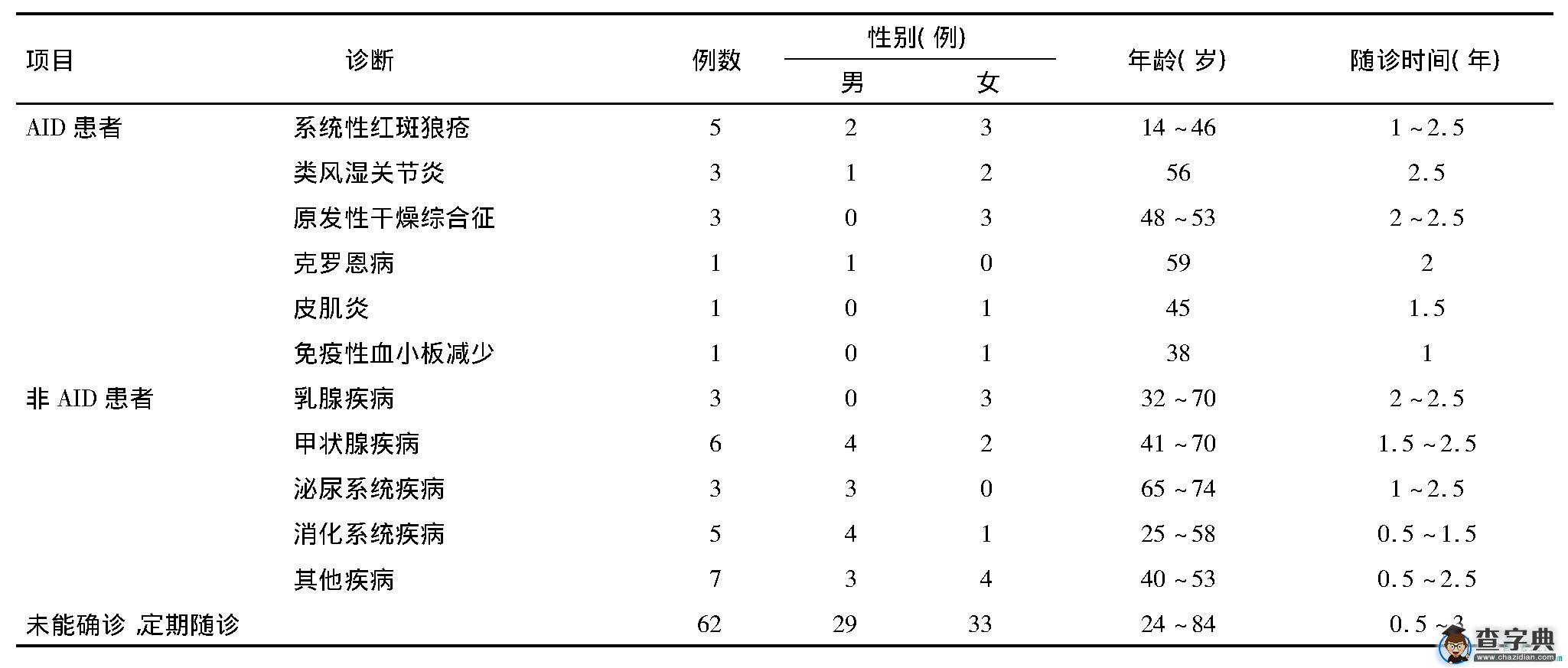
对100名自身抗体检测结果异常患者进行临床随访, 每3~6个月随访1次, 随访持续时间为0.5~2.5年, 随访过程中, 确诊AID患者14例, 其中女10例, 占10%, 男4例, 占4%。确诊非AID患者24例, 其中女10例, 占10%, 男14例, 占14%。另外62名体检者临床随诊未能确诊任何疾病, 嘱其继续临床随诊。见表2。
2.3 确诊AID与非AID患者自身抗体与免疫学功能检测分析
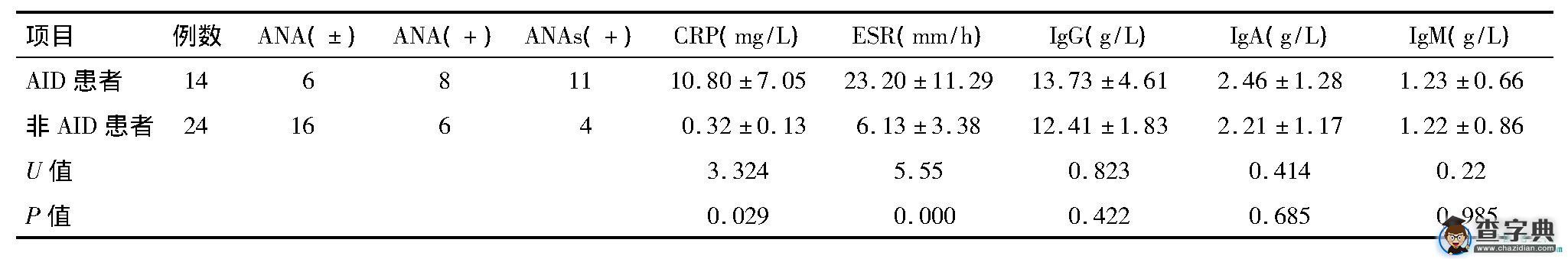
AID组ANA弱阳性与阳性分别占42.9%和57.1%, ANAs阳性率为78.6%, 非AID患者ANA弱阳性与阳性分别为66.7%和25%, ANAs阳性率为16.6%。AID组免疫学指标CRP和ESR均高于非AID组 (P0.05) 。IgG、IgA、IgM在两组间的差异无统计学意义。见表3。
3 讨论
随着医务工作者认识水平的提高、实验室技术的推广普及, 自身抗体在临床的应用越来越广泛, 确诊AID的患者越来越多。现今自身抗体已成为了AID的诊断性生物标志物, 并且与疾病的分化、临床转归及治疗预后密切相关[1]。此外, 随着人们健康意识的增加, 研究者在研究自身抗体诊断价值的同时, 进一步挖掘了自身抗体的预警价值。Arbuckle等[4]追踪系统性红斑狼疮患者确诊前的血清标本, 发现自身抗体出现异常要早于临床确诊前9.4年, Jonsson等[3]也证实早在原发性干燥综合征患者出现临床症状前3.7年, 这些患者血清中就可以检测到ANA及抗SSA、SSB等疾病特异性自身抗体。而原发性胆汁性肝硬化患者甚至可以在临床发病前十几年就存在抗线粒体抗体[5]。这些研究表明, 自身抗体的筛查为预防及预测AID的过程提供了线索。
表2 100例自身抗体异常者随诊情况及临床诊断
表3 诊断AID与非AID患者比较
本研究对1 157名健康体检者进行血清自身抗体检测, 检测结果异常者嘱其临床随诊。结果显示, ANA总体阳性率为7.35%, 女性阳性率要高于男性阳性率 (P0.05) , ANAs总体阳性率为3.8%, 女性阳性率要高于男性阳性率 (P0.05) 。本研究ANA及ANAs的阳性率均低于国内学者胡朝军等[2]的研究结果11.27%和8.69%, 其可能的原因是环境因素及人群差异。AID的发病是环境因素、遗传因素及个体因素共同作用的结果[6], 研究所处的地域不同, 环境因素不同, 导致人群产生抗体的阳性率也不相同。100名自身抗体异常患者嘱其3~6个月进行1次临床随诊, 在随诊过程中, 经风湿免疫科和内科全面系统诊疗, 最终14例患者确诊为AID, 占1.21%, 这提示在本研究中, ANA和 (或) 疾病特异性ANAs在AID患者临床确诊前就已存在患者血清中。自身抗体对疾病的临床表现发展的预测价值部分与自身抗体的致病作用有关[7]。有文献报道, 将自身抗体注射到动物模型体内会引起动物模型临床表现的快速发生[8]。另外一些致病性自身抗体, 如抗内因子抗体, 直接影响维生素B12的摄取, 随后的维生素B12缺乏症和恶性贫血的发生发展则需要时间来进行[9]。更甚者, 自身抗体对于疾病的预测价值, 不仅局限于抗体的数量, 而且各种抗体的含量水平, 如抗胰岛细胞抗体、抗谷氨酸脱羧酶等都可以作为风险评分准确预测1型糖尿病的发生[10]。
自身抗体可出现在多种非AID中, 如病毒性肝炎[11]、癌症[12]等。本研究中有24名随诊体检者确诊非AID, 占2.07%, 包括肾脏疾病、甲状腺疾病、消化系统疾病等。非AID中的自身抗体在疾病的发生过程中仅作为某些组织受损的标志, 或是由微生物感染所致[13]。另外, 62名随诊的体检者未发现异常, 仅出现自身抗体结果异常或处于亚健康状态, 50岁以上体检者约为2/3。随着年龄的增长, 体内自身抗原暴露的机会增大, 体内产生自身抗体的概率也相应增加。而此类生理学自身抗体效价低, 不足以引起自身组织的破坏, 且可以协助清除衰老蜕变的自身成分, 起到免疫自稳效应。
确诊AID患者自身抗体结果显示, ANA弱阳性与阳性率分别为42.9%和57.1%, ANAs的阳性率为78.6%, 这提示ANA作为筛查实验, 出现弱阳性结果时也需要引起注意, 联合疾病特异性ANAs或器官特异性自身抗体检测可提高疾病诊断的阳性率。CRP和 (或) ESR作为免疫活动功能常规的检测指标, AID患者均高于非AID患者, 差异有统计学意义 (P0.05) , 说明自身抗体联合CRP和ESR对于健康体检者筛查AID有一定的临床意义。此外, Ig亚型却没有明显的差异, 可能的原因是不同的AID其Ig变化的类型及程度不同, 导致无统计学上差异。
综上所述, 自身抗体可在AID临床确诊前出现在患者体内, 自身抗体对AID有预警作用。在健康体检中将自身抗体列入常规检查项目是非常必要和有价值的, 特别是免疫功能常规指标, 如CRP、ESR等出现异常时, 要警惕AID的发生。自身抗体筛查异常者建议临床随诊, 风湿免疫科医生需提供相关的随访咨询及健康教育, 以便对AID早期发现、早期干预、早期治疗。
参考文献:
[1] Damoiseaux J, Andrade LE, Fritzler MJ, et al.Autoantibodies2015:From diagnostic biomarkers toward prediction, prognosis and prevention[J].Autoimmun Rev, 2015, 14 (6) :555-563.
[2]胡朝军, 陈华, 王立, 等.体检人群中自身抗体筛查的临床意义[J].中华检验医学杂志, 2014, 37 (11) :847-850.
[3] Jonsson R, Theander E, Sj9str9m B, et al.Autoantibodies present before symptom onset in primary Sj9gren syndrome[J].JA-MA, 2013, 310 (17) :1854-1855.
[4] Arbuckle MR, Mc Clain MT, Rubertone MV, et al.Development of autoantibodies before the clinical onset of systemic lupus erythematosus[J].N Engl J Med, 2003, 349 (16) :1526-1533.
[5] Abe M, Onji M.Natural history of primary biliary cirrhosis[J].Hepatol Res, 2008, 38 (7) :639-645.
[6] Avidson A, Diamond B.Autoimmune diseases[J].N Engl JMed, 2001, 345 (5) :340-350.
[7] Lahmer T, Heemann U.Anti-glomerular basement membrane antibody disease:a rare autoimmune disorder affecting the kidney and the lung[J].Autoimmun Rev, 2012, 12 (2) :169-173.
[8]Hu CJ, Zhang FC, Li YZ, et al.Primary biliary cirrhosis:what do autoantibodies tell us?[J].World J Gastroenterol, 2010, 16 (29) :3616-3629.
[9] Hu ZD, Deng AM.Autoantibodies in pre-clinical autoimmune disease[J].Clin Chim Acta, 2014, 437:14-8.
[10] Sosenko JM, Skyler JS, Palmer JP, et al.The prediction of type1 diabetes by multiple autoantibody levels and their incorporation into an autoantibody risk score in relatives of type 1 diabetic patients[J].Diabetes Care, 2013, 36 (9) :2615-2620.
[11]徐振兴, 滕菁, 毛乾国, 等.肝功能异常患者血清自身抗体的检测分析[J].实用医学杂志, 2015, 31 (3) :391-394.
[12]贾静, 任娟, 黄晓明, 等.自身抗体分子在肺癌早期诊断中的应用[J].实用医学杂志, 2013, 29 (2) :319-321.
[13] Bogdanos DP, Baum H, Butler P, et al.Association between the primary biliary cirrhosis specific anti-sp100 antibodies and recurrent urinary tract infection[J].Dig Liver Dis, 2003, 35 (11) :801-805.
